In diesem Beitrag wird beschrieben wie das chemische Gleichgewicht funktioniert und mittels eines einfachen Versuchs wird dieses Beispiel verdeutlicht. Doch vor Beginn des Experimentes müssen ein Paar Begriffe geklärt werden. Die Beobachtungen für diesen Versuch können dann mittels Versuchsprotokoll festgehalten werden.
Was ist ein chemisches Gleichgewicht
Das chemische Gelichgewicht einfach erklärt – Bei einer chemischen Reaktion von Ausgangsstoffen (Edukten) entstehen neue chemische Verbindungen (Produkte) – Hinreaktion. Wenn sich diese Verbindung wieder in seine Ausgangsstoffe zerlegen möchte, entsteht eine weitere Reaktion – Rückreaktion. Beide Reaktionen finden dabei gelichzeitig statt. Ab einem gewissen Punkt lässt sich allerdings keine Reaktion mehr erkennen (Die Reaktion findet trotzdem dauerhaft statt). Es hat sich ein Gelichgewicht eingestellt. Dieser Gleichgewichts-Punkt lässt sich berechnen und mittels der Gleichgewichtskonstante beschreiben. Diese Konstante lässt sich durch bestimmte Merkmale wie Druck, Temperatur oder anderer Einflüsse verschieben. Voraussetzung für diesen Versuch ist ein geschlossenes System. Sobald bestimmte Stoffe die Möglichkeit haben aus dem System zu entweichen, kann ab einem bestimmten Punkt keine Reaktion mehr stattfinden.
Einfach erklärt – Zwei reversible Reaktionen finden gleichzeitig statt. Das Ergebnis beider Reaktionen ist gleich groß. Dadurch sind keine Veränderungen sichtbar, da sich beide Reaktionen ausgleichen. Es hat sich ein Gleichgewicht eingependelt
Chemisches Gleichgewicht berechnen
Das chemische Gleichgewicht lässt sich durch das Massenwirkungsgesetz berechnen. Hierfür muss die Gleichgewichtskonstante berechnet werden. Die Formel hierfür ist:
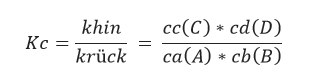
Ist das die Gleichgewichtskonstante größer als 1 entstehen mehr Produkte. Ist die Kontante kleiner als 1 entstehen mehr Edukte. Ist die Gleichgewichtskonstante gleich 1, ist die Entstehung von Edukten und Produkten gleich.
Modellversuch chemisches Gleichgewicht
Wenn man Beispielsweise Wasser(H2O) unter Beteiligung von Kohlenstoffdioxid(CO2) mit Kalk (Calciumoxid CaO) vermische, entsteht Calciumhydroxid. Hierbei sind Wasser und Kalk die Edukte und das Calciumhydroxid die Produkte. Diese Reaktion lässt sich auch in die andere Richtung rückgängig machen. Voraussetzung hierfür ist die Beteiligung von Kohlenstoffdioxid. Dieser Stoff ist notwendig für diese Reaktion. Wenn man nun mit einem Strohhalm in das Wasser pustet, wird Kohlenstoffdioxid der Mischung beigesetzt. Der Kalk löst sich nun besser auf und man kann erkennen, dass das Wasser klarer wird. Wenn man nun die Temperatur der Mischung erhöht, sorgt man dafür, dass sich das Kohlenstoffdioxid wieder verflüchtigt. Man wird direkt eine Trübung des Wassers feststellen. Beide Reaktionen finden immer gleichzeitig statt. Die Löslichkeit (Gleichgewichtskonstante) lässt dich hier durch Beeinflussung äußerer Einwirkung verschieben. Man spricht hier von einem chemischen Gleichgewicht.
Chemisches Gleichgewicht – Aufgaben mit Lösungen
Weitere Aufgaben mit Lösungen für das chemische Gleichgewicht finden Sie hier.
